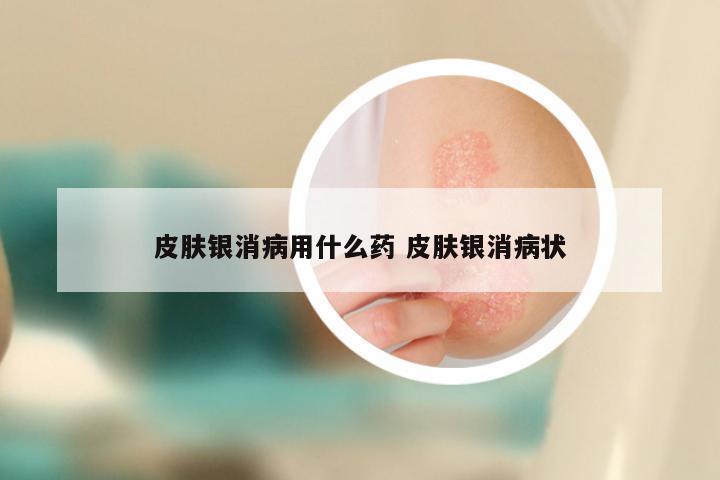
美国治银屑病新药礼来 2020年美国治疗银屑的特效药
国内已上市银屑病生物制剂汇总
1、目前,国内银屑病生物制剂治疗领域已经涵盖了多种不同类型的药物,包括TNF-α抑制剂、IL-17A抑制剂和IL-23抑制剂等。
2、国内已上市的银屑病生物制剂包括以下几种:修美乐:生产厂家:艾伯维公司。类型:全人源抗TNFa抑制剂。上市时间:2010年。适应症:类风湿性关节炎、强直性脊柱炎和斑块状银屑病。类克:生产厂家:强生公司。类型:针对TNFα的人鼠单克隆嵌合抗体。上市时间:2007年。适应症:重度斑块型银屑病。
3、益赛普 益赛普是依那西普的国产生物制剂,于1998年11月获FDA批准上市,2006年在中国上市。适应症为银屑病治疗。单价643元,规格为25mg/支,用药方式为皮下注射,每次25mg,每周2次,每次间隔3-4天。购药优惠活动包括4赠12赠120赠28等。

匹康奇拜单抗、莫米司特等2025年有望批准的15款免疫疾病新药
匹康奇拜单抗、莫米司特等2025年有望批准的15款免疫疾病新药如下:匹康奇拜单抗 作用机制:抗IL-23p19抗体 适应症:中重度斑块状银屑病 进展:2024年9月,信达生物1类新药匹康奇拜单抗注射液上市申请获CDE受理。3期临床数据显示,第16周PASI90应答率超80%,且每12周给药一次,显著提升患者依从性。
什么是美国礼来公司
1、美国礼来公司(Eli Lilly and Company)是一家全球性以研发为基础的医药公司。发展历程:1876年5月10日由礼来上校创立于美国,1901年在印第安纳州注册成立,1918年进入中国市场。公司规模:总部位于美国印第安纳州印第安纳波利斯市,全球约42,000名员工,逾10,000名员工参与研发。
2、美国礼来公司(Eli Lilly and Company)是一家全球领先的以研发为基础的医药公司,以下是其简介全貌:基本概况:成立于1876年5月10日,总部位于美国印第安纳州印第安纳波利斯市,在纽约证券交易所上市(NYSE: LLY),是标准普尔500指数成分股。
3、美国礼来公司(Eli Lilly and Company)是一家全球性的以研发为基础的医药公司,致力于为全人类提供以药物为基础的创新医疗保健方案,使人们生活过得更长久、更健康、更有活力。礼来是拥有130年历史的世界领先制药公司。礼来于1918年来到中国,将其第一个海外代表处设在上海,从而迈出了全球化的第一步。
4、自1918年,美国礼来公司在繁华的上海开创了海外首个办事处,开启了其全球化进程的第一步。历经岁月变迁,对中国市场的执着情感始终如一。1993年,礼来公司选择回归,成立了美国礼来亚洲公司上海代表处,自此在中国的版图上拓展开来。
这条明星信号通路已催生多款重磅新药,治疗多种炎症性疾病
1、IL12和IL23/IL17信号通路已催生多款重磅新药,用于治疗类风湿性关节炎、炎症性肠病、脊柱关节炎和银屑病等多种炎症性疾病。具体来说:类风湿性关节炎:针对IL23/IL17信号通路的疗法,如IL12和IL23抑制剂,以及抗IL23特异性抗体,为类风湿性关节炎患者提供了新的治疗选择。
2、慢性炎症性疾病,如类风湿性关节炎、炎症性肠病(IBD)、脊柱关节炎和银屑病等,对患者生活造成严重影响。过去,对这些疾病发病机制理解不足阻碍了有效疗法的开发。但近年来,全基因组关联研究(GWAS)发现与慢性炎症性疾病相关基因变异,揭示了IL-12和IL-23/IL-17信号通路在这些疾病中的关键作用。
3、综上所述,HMGB1蛋白作为炎症反应的幕后推手,在多种疾病的病理发展中发挥着重要作用。随着对其结构和信号通路的深入了解以及针对其的药物研发的进展,HMGB1有望成为治疗多种炎症性疾病和肿瘤的新靶点。
4、实验中,通过抑制Cu(II)离子的活性,研究人员成功地减少了炎症反应。这表明铜信号通路可能是治疗炎症性疾病的一个潜在靶点。然而,目前尚未开发出针对这个通路的特定药物或治疗方法。尽管如此,研究人员已经开发了一种名为metformin二聚体的药物,该药物可以抑制线粒体中铜(II)离子的活性。
5、IL-12/IL-23通路在疾病中的作用 大量临床研究发现,IL-23在多种自身免疫性疾病中含量增加,包括银屑病、炎症性肠病、类风湿性关节炎和多发性硬化症等。同时,IL-23可以诱导Th17细胞的成熟因子,后者又被证明为自身免疫的主要参与者。因此,IL-23也是自身免疫疾病信号通路的重要组成部分。
6、IL-17的促炎特性是其宿主保护能力的关键。然而,不受限制的IL-17信号也与自身免疫性疾病和癌症进展相关。这一发现为IL-17成为自身免疫性疾病治疗靶点提供了理论基础。
礼来AD单抗新药Kisunla获得FDA批准上市,但与仑卡奈单抗同样无法改变AD...
年7月2日,礼来公司的新药多奈单抗(donanemab,商品名Kisunla)获得美国FDA正式批准,用于治疗早期阿尔茨海默病(AD)患者。这一批准使得Kisunla成为在美国上市的第二种治疗AD的单抗药物,与卫材/渤健的仑卡奈单抗(Lecanemab,商品名Leqembi)形成直接竞争。