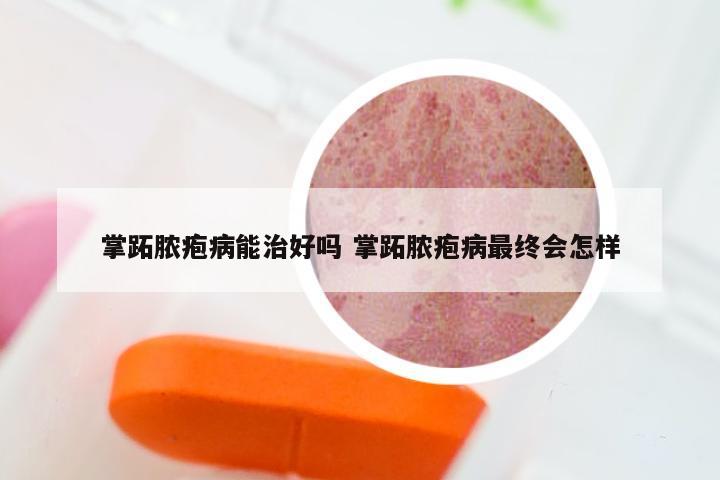
银屑病临床试验招募志愿者 银屑病生物制剂临床试验招募2021
...ELPIS人脐带间充质干细胞注射液”银屑病Ⅰ期临床于华山医院率先启动...
1、华夏源自主研发的“ELPIS人脐带间充质干细胞注射液”已获得国家食品药品监督管理局的批准,用于开展治疗成年中、重度慢性斑块型银屑病患者I期临床试验。临床试验地点与负责人:临床试验在复旦大学附属华山医院率先启动。华山医院皮肤科的徐金华主任和I期临床中心张菁主任共同担任项目首席研究者。
3个月一针,超半数银屑病患者一年内皮肤完全清除,新药Risankizumab为啥这...
一项新药SKYRIZI(risankizumab)在日本取得突破,被批准用于多种银屑病类型,包括斑块性、脓疱性、红皮病性及关节炎,让全球银屑病患者瞩目。这款药物在临床试验中显示了显著优势,尤其在16周和52周的疗效上,其皮肤清除效果超过同类药物如STELARA和HUMIRA。
在一年内(52周), 有56%和60%的risankizumab治疗患者达到了完全皮肤清除(PASI 100), 而相对应的STELARA治疗组数据分别为21%和30%;而且在治疗斑块状银屑病3期研究没有出现新的安全事件。
显著的皮损清除效果:根据一年期网络荟萃分析,Taltz在银屑病面积和严重程度指数100标准下,皮损完全清除的累计益处明显优于adalimumab、brodalumab、etanercept、guselkumab、risankizumab、secukinumab和ustekinumab等药物。
使用PASI 100衡量,Taltz在一年期间为患者提供了大约44%的时间皮损完全清除,远超其他7种生物制剂。

安进药物Otezla在美国上市,用于治疗儿科斑块状银屑病
安进药物Otezla(阿普斯特)已在美国上市,用于治疗6岁及以上儿科中重度斑块状银屑病。Otezla(apremilast,阿普斯特)是生物技术公司安进研发的一款药物,现已在美国获批用于治疗年龄6岁及以上、体重至少44磅且适合接受光疗或全身治疗的儿科中重度斑块状银屑病患者。
自2014年首次获美国FDA批准上市以来,Otezla已在美国治疗了超过25万例中重度斑块型银屑病或活动性银屑病关节炎患者。随着其适应症的扩大,Otezla的市场前景将更加广阔。此外,Otezla的获批也为银屑病的治疗带来了新的希望,为患者提供了更多元化的治疗选择。
年,原研药Otezla在美国上市,获批适应症包括用于治疗成年活动性银屑病关节炎、中度至重度斑块型银屑病和与贝赫切特综合征相关的口腔溃疡。2019年8月,安进以高达134亿美元的价格收购阿普斯特,成功将其纳入麾下。据其财报数据显示,2018年,Otezla销售额达108亿美元,增速在20%以上。
年2月,安进在国内提交了阿普米司特片的新药上市申请,并于同年8月获批上市,获批剂型为片剂,规格包括10 mg、20 mg、30 mg,商品名为欧泰乐/OTEZLA。这是中国首个获批用于斑块状银屑病治疗的口服PDE4抑制剂。
Sotyktu是十多年来首个针对中至重度斑块型银屑病成人患者的新疗法,有望挑战目前由安进Otezla疗法控制的23亿美元的市场份额。Sotyktu的高定价也反映了其作为新疗法的市场潜力和价值。中国市场进展:在中国市场,百时美施贵宝也取得了显著进展。两款重磅药物利布洛泽和欧狄沃分别获批上市和新增适应症。
重磅!银屑病新药Deucravacitinib即将上市
银屑病新药Deucravacitinib即将上市,这是银屑病治疗领域的一项重大突破。以下是关于Deucravacitinib的详细解药物类型与机制:Deucravacitinib是一款口服TYK2别构抑制剂。它通过选择性抑制TYK2来提高疗效,并降低可能的副作用。
百时美施贵宝(BMS)公布的评估新型抗炎药deucravacitinib(BMS-986165)治疗银屑病关节炎(PsA)的II期临床研究结果显示,deucravacitinib在治疗银屑病关节炎方面取得了显著疗效,特别是在改善疾病症状和体征方面。
针对TYK2的独特结构:deucravacitinib是首款TYK2别构抑制剂,其设计针对TYK2的JH2结构域,该结构域与JH1结构域的差异为药物设计提供了契机。通过与JH2结构域精确结合,deucravacitinib能够调控TYK2的抑制性相互作用,从而抑制TYK2及其下游信号传导路径的激活。